Carcinoma mammario
La neoplasia della mammella rappresenta la neoplasia più frequente (1) e la prima causa di morte per tumore nel genere femminile (1). In Italia si sta osservando un lieve trend in aumento per quanto riguarda l’incidenza e una tendenza alla diminuzione della mortalità per carcinoma mammario (2).
La maggior parte dei casi di tumore mammario sono sporadici, e solo il 5-7% sono forme ereditarie (2).
Ad oggi, la mammografia con cadenza biennale nelle donne con età compresa tra i 50 e 69 anni è la procedura di screening più efficace (2).
Il tumore mammario è la patologia oncologica a maggior incidenza nelle donne, in cui 1 diagnosi di tumore ogni 3 è dovuta ad un carcinoma mammario (1). Nel 2020 sono stati stimati circa 55.000 nuovi casi di carcinoma mammario (1), e circa 834.000 sono le donne che vivono con una diagnosi di tumore della mammella (3).
In Italia, il trend di incidenza appare in lieve aumento, mentre la mortalità è in continua discesa (2). La malattia presenta un’ampia variabilità geografica, con una maggiore incidenza al Nord, rispetto al Centro e al Sud, a causa della diversa diffusione dello screening mammografico e della presenza dei fattori di rischio (2).
A 5 anni, la sopravvivenza delle pazienti con diagnosi di tumore mammario è intorno all’88%, senza differenze nelle diverse fasce di età (3).
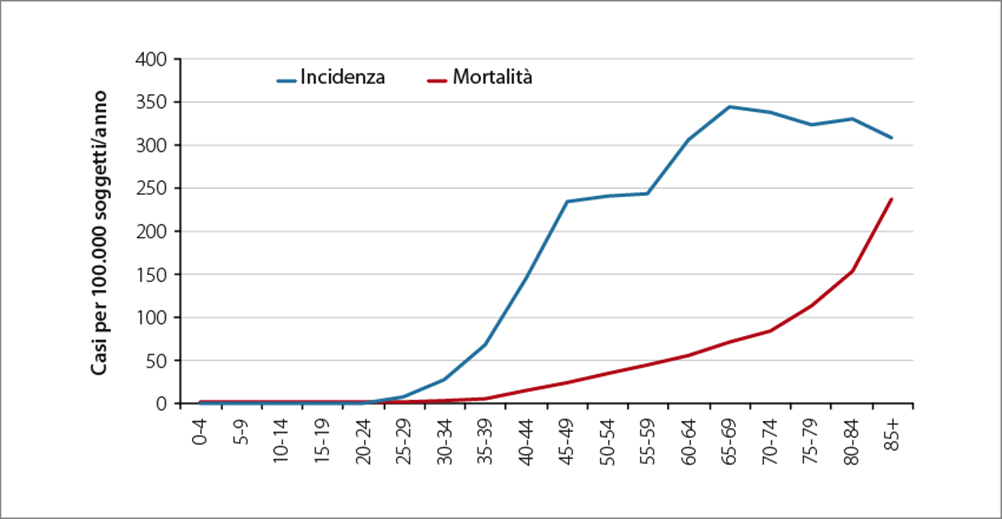
(mod. da 1).

(mod. da 1)
Il rischio di sviluppare il tumore della mammella aumenta con l’età: questo potrebbe essere principalmente legato alla modificazione costante dell’epitelio ghiandolare mammario, unitamente al progressivo danneggiamento a carico del DNA (1).
Altri fattori di rischio riconosciuti sono:
- fattori ormonali: un rischio aumentato di sviluppare un tumore mammario è osservato in donne che hanno fatto uso di terapia ormonale sostitutiva per la menopausa; analogamente, un rischio incrementato è presente nelle donne che assumono contraccettivi orali 1;
- fattori riproduttivi: una durata di esposizione più lunga dell’epitelio ghiandolare agli estrogeni, in caso di menarca precoce e menopausa tardiva, unitamente alla nulliparità, ad una prima gravidanza dopo i 30 anni e il mancato allattamento al seno 1;
- fattori dietetici: l’obesità (con l’eccesso di tessuto adiposo che rappresenta la principale fonte di sintesi degli estrogeni circolanti in post menopausa), l’elevato consumo di alcool e di grassi animali, il ridotto consumo di fibre vegetali. Quindi, l’adozione di corretti stili di vita, con una regolare attività fisica quotidiana e una dieta mediterranea equilibrata, porterebbe a un miglioramento dell’assetto metabolico e una riduzione del rischio di sviluppare un carcinoma mammario 1;
- pregressa radioterapia a livello toracico 1;
- fattori ereditari: solo il 5-7% dei tumori mammari sono ereditari, e in gran parte legati alla mutazione dei geni BRCA 1 e/o 2 1. La mutazione a carico dei geni BRCA1 e BRCA2 è associata a circa il 15% dei tumori triplo negativi4.
FOCUS: mutazioni dei geni BRCA
La presenza di una variante patogenetica germinale nei geni BRCA1 e BRCA2 espone il soggetto portatore ad un aumentato rischio di sviluppare alcune forme tumorali nel corso della vita, in particolare neoplasie della mammella e dell’ovaio. Questi geni infatti contengono informazioni utili a codificare la produzione di proteine coinvolte nel mantenimento dell’integrità del DNA e nei meccanismi di riparazione dei danni ad esso indotti.
Perché è importante sottoporsi al test di ricerca di queste mutazioni nei casi selezionati?
La mutazione patogenetica germinale dei geni BRCA1 o BRCA2 in soggetti sani procura una situazione di aumentato rischio, nel corso della vita, di sviluppo di carcinoma della mammella (40- 80%) e dell’ovaio (11-40%). La presenza della mutazione non significa quindi sviluppo certo di queste patologie (5,6).
Tutte le pazienti con carcinoma ovarico, non mucinoso e non borderline, devono essere testate per la ricerca della mutazione BRCA al momento della diagnosi (6).
Il test BRCA può essere eseguito sia sul sangue periferico sia sul tessuto neoplastico, evidenziando in questo ultimo caso sia le varianti ereditarie, sia le varianti acquisite per mutazione somatica. In presenza di un test positivo su tessuto tumorale va sempre eseguito il test genetico su campione di sangue per distinguere le mutazioni germinali, che rendono necessaria la consulenza genetica e il test nei familiari del probando, da quelle somatiche (fig.2) (7).
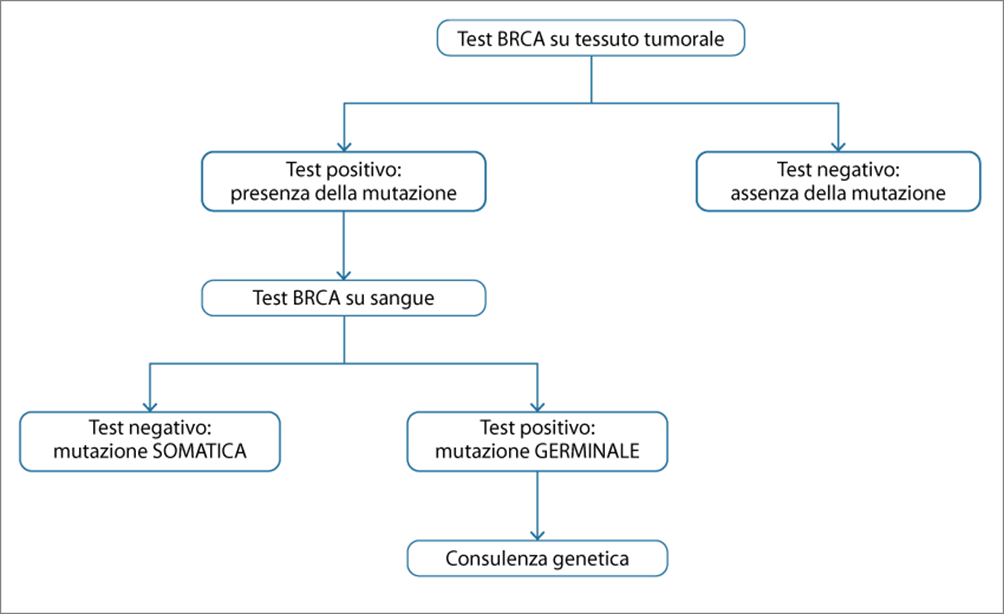
Per quanto riguarda l’esecuzione del test BRCA nelle pazienti con tumore della mammella, a differenza della patologia ovarica non vi è per ora indicazione allargata a tutte le pazienti, nonostante l’argomento risulti attuale e discusso (5).
I criteri per l’invio alla consulenza genetica oncologica del/della paziente con carcinoma mammario sono attualmente le seguenti:
- Storia personale di:
- Carcinoma della mammella maschile
- Donna con carcinoma della mammella e dell’ovaio
- Donna con carcinoma della mammella <36 anni
- Donna con carcinoma della mammella triplo negativo <60 anni
- Donna con carcinoma della mammella bilaterale <50 anni
- Storia personale di carcinoma mammario <50 anni e familiarità di primo grado per:
- Carcinoma della mammella <50 anni
- Carcinoma dell’ovaio non mucinoso o borderline in qualsiasi età
- Carcinoma della mammella bilaterale
- Carcinoma della mammella maschile
- Storia personale di carcinoma della mammella >50 anni e familiarità per carcinoma della mammella, dell’ovaio in due o più parenti di primo grado tra loro (di cui uno in primo grado con la paziente).
- Storia familiare di variante patogenetica nota di un gene predisponente in un familiare.
Questi criteri individuano situazioni associate ad una probabilità̀ superiore al 10% di identificare una variante patogenetica BRCA germinale, e rappresentano quindi un’indicazione all’esecuzione di un test con accettabile rapporto costi/benefici (5).
L’espressione di PD-L1 è uno dei fattori predittivi riconosciuti di risposta all’immunoterapia.
Questo biomarcatore riveste un ruolo chiave per la strategia terapeutica del tumore mammario triplo negativo metastatico in prima linea: per le pazienti con espressione di PD-L1, l’aggiunta dell’immunoterapico anti-PD-L1 atezolizumab alla chemioterapia con nab-paclitaxel ha dimostrato, rispetto alla sola chemioterapia, di incrementare la sopravvivenza libera da progressione nella popolazione generale dello studio di fase III IMpassion130 e la sopravvivenza globale nella popolazione PD-L1 positiva. La combinazione atezolizumab+nab-paclitaxel è ad oggi prescrivibile in Italia in regime di rimborsabilità da parte del SSN (3,8).
Lo studio KEYNOTE-355 ha valutato l’aggiunta dell’immunoterapico anti-PD-1 pembrolizumab alla chemioterapia (paclitaxel, nab-paclitaxel o carboplatino+gemcitabina) nel trattamento di prima linea delle pazienti con tumore mammario metastatico triplo negativo PD-L1 positivo (misurato come Combined Positive Score, CPS, ovvero numero di cellule tumorali e immunitarie PD-L1 positive diviso per il numero totale di cellule tumorali e moltiplicato per 100).
La combinazione di immunoterapia e chemioterapia ha dimostrato un vantaggio in sopravvivenza libera da progressione e sopravvivenza globale rispetto alla sola chemioterapia nel sottogruppo di pazienti con PD-L1 CPS >10. Ad oggi, questo trattamento è approvato dalla European Medicine Agency ma non è rimborsato in Italia.
In genere le forme iniziali di tumore mammario non sono associate a dolore (9).
Il segno clinico che nella maggior parte dei casi agisce da “spia” è la rilevazione palpatoria di un nodulo mammario (9).
I principali sintomi e/o segni, spesso associati a forme tumorali avanzate, che devono essere immediatamente approfondite sono (9):
- la comparsa di noduli palpabili e/o visibili;
- alterazioni del capezzolo, come ad esempio una retrazione, con eventuali secrezioni;
- alterazioni nella forma della mammella e della cute (“cute a buccia d’arancia”).
La diagnosi si basa principalmente sull’esecuzione della mammografia, in particolare per le forme iniziali, senza segni e/o sintomi associati (1).
Per le donne giovani, con un seno più denso, deve essere effettuata anche l’ecografia, per una migliore definizione dell’anatomia dei reperti mammari e delle caratteristiche di composizione dei tessuti (9). L’eventuale identificazione di noduli sospetti porta all’esecuzione di una biopsia, con esame microistologico, per ottenere una diagnosi di natura e determinare i fattori biologici (recettori per gli estrogeni, recettori per il progesterone, status di Her2). La classificazione molecolare guida la successiva terapia, ove indicata (2).
La RM mammaria trova maggior indicazione come esame di stadiazione della malattia ad estensione loco-regionale (2).
TC, PET/TC e scintigrafia ossea sono per lo più utilizzate nei casi a rischio elevato di malattia metastatica asintomatica, o nella stadiazione di casi noti di malattia in stadio avanzato (2).
La mammografia ad oggi è ritenuta la forma di screening più efficace, con una riduzione della mortalità e un aumento delle diagnosi in stadio iniziale. La mammografia di screening è indirizzata alle donne con età compresa tra i 50 e i 69 anni, con cadenza biennale (2). Per le donne con età compresa tra 40 e 49 anni, la cadenza andrebbe personalizzata sulla base dei fattori di rischio individuali quali la storia familiare e la densità mammaria.
Nelle donne con elevato rischio individuale (o per mutazione dei geni BRCA1/2 o per storia familiare), i primi controlli radiologici dovrebbero essere effettuati a partire dai 25 anni o 10 anni prima dell’età di insorgenza del tumore nel familiare più giovane (1). Per le pazienti con mutazioni BRCA1/2, deve essere effettuata RM mammaria con mezzo di contrasto (mdc) annuale, come metodica di screening (1).
Solo nel 6-7% dei casi il tumore alla mammella si presenta metastatico già alla diagnosi. La maggior parte delle diagnosi di tumore della mammella avviene infatti in stadio iniziale e la chirurgia rappresenta il gold-standard di trattamento. Il percorso terapeutico prevede una chirurgia conservativa associata a radioterapia, oppure la mastectomia, seguita da una terapia adiuvante (ormonoterapia, chemioterapia, terapia a bersaglio molecolare) per ridurre il rischio di recidiva (3).
La terapia neoadiuvante pre-chirurgica è indicata nelle forme localmente avanzate inoperabili e in caso di carcinoma infiammatorio (per ottenere un down-staging del tumore, rendendolo quindi operabile), nelle forme resecabili ma candidate a mastectomia (al fine di aumentare le possibilità di chirurgia conservativa) o nel carcinoma mammario ad alto rischio di recidiva. La terapia neoadiuvante permette inoltre di calibrare il trattamento post-operatorio dei tumori triplo negativi e HER2-positivi sulla base della presenza di malattia residua all’intervento chirurgico, potenziandolo laddove sia presente malattia residua e depotenziandolo laddove sia stata ottenuta una risposta completa patologica. Le linee guida nazionali e internazionali considerano infatti la terapia sistemica neoadiuvante come trattamento di elezione per questi sottotipi biologici, anche negli stadi precoci (con coinvolgimento linfonodale e/o cT>1.5 cm) (3).
- I numeri del cancro in Italia, rapporto AIOM-AIRTUM 2019 e 2020
- Linee Guida AIOM Neoplasie della mammella, edizione 2020
- I numeri del cancro in Italia, rapporto AIOM-AIRTUM 2021
- Stevens KN, Vachon CM, Couch FJ. Genetic susceptibility to triple-negative breast cancer. Cancer Res. 2013 Apr 1;73(7):2025-30.
- Raccomandazioni 2019 per l’implementazione del test BRCA nelle pazienti con carcinoma mammario e nei familiari a rischio elevato di neoplasia – AIOM
- Raccomandazioni 2019 per l’implementazione del test BRCA nelle pazienti con carcinoma ovarico e nei familiari a rischio elevato di neoplasia – AIOM
- Linee guida AIOM 2019 Tumori dell’ovaio
- Linee Guida AIOM Neoplasie della mammella, edizione 2021
- Website AIRC, tumore del seno
IT-NON-07448-W-09-2024